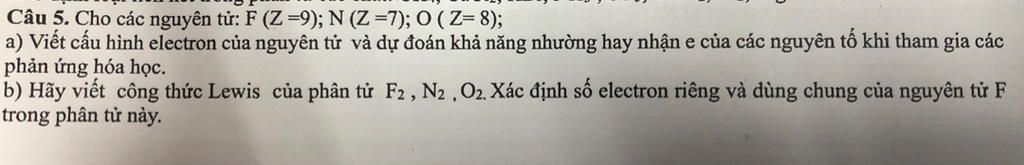Giúp với ạ cảm ơn nhiều
-
Exercise
-
QandA
-
Foros
- Lớp 2
- Tự nhiên và xã hội
- Tiếng việt
- Toán học
- Tiếng Anh
- Đạo đức
- Âm nhạc
- Mỹ thuật
- HĐ trải nghiệm, hướng nghiệp
- Lớp 4
- Khoa học
- Tiếng việt
- Toán học
- Đạo đức
- Tiếng Anh
- Lịch sử và Địa lí
- Công nghệ
- HĐ trải nghiệm, hướng nghiệp
- GD Thể chất
- Âm nhạc
- Lớp 5
- Khoa học
- Toán học
- Tiếng việt
- Tin học
- Tiếng Anh
- Đạo đức
- Lịch sử và Địa lí
- HĐ trải nghiệm, hướng nghiệp
- Lớp 6
- Công nghệ
- Tin học
- Lịch sử và Địa lí
- GDCD
- Ngữ văn
- Toán học
- Khoa học tự nhiên
- Tiếng Anh
- Âm nhạc
- Mỹ thuật
- HĐ trải nghiệm, hướng nghiệp
- Lớp 7
- Tiếng Anh
- GDCD
- Toán học
- Công nghệ
- Tin học
- Ngữ văn
- Lịch sử và Địa lí
- Khoa học tự nhiên
- HĐ trải nghiệm, hướng nghiệp
- Âm nhạc
- Lớp 8
- Tiếng Anh
- GDCD
- Toán học
- Công nghệ
- Ngữ văn
- Khoa học tự nhiên
- Lịch sử và Địa lí
- HĐ trải nghiệm, hướng nghiệp
- GD Thể chất
- Âm nhạc
- Lớp 9
- Tiếng Anh
- GDCD
- Toán học
- Công nghệ
- Tin học
- Ngữ văn
- Khoa học tự nhiên
- HĐ trải nghiệm, hướng nghiệp
- Lịch sử và Địa lí
- Lớp 10
- Hóa học
- Tiếng Anh
- Lịch sử
- Sinh học
- Địa lí
- Vật lí
- Tin học
- Toán học
- GD kinh tế và pháp luật
- Công nghệ
- Ngữ văn
- HĐ trải nghiệm, hướng nghiệp
- GD Thể chất
- GD Quốc phòng và An ninh
- Lớp 11
- Hóa học
- Tiếng Anh
- Vật lí
- Tin học
- Toán học
- Địa lí
- Công nghệ
- Lịch sử
- Ngữ văn
- Sinh học
- GD Thể chất
- GD Quốc phòng và An ninh
- GD kinh tế và pháp luật
- HĐ trải nghiệm, hướng nghiệp
-
Chat
-
Juegos

- EXPLORE
-
Exercise
-
QandA
-
Foros
-
Tài liệu & đề thi
-
Ngữ pháp
-
Chat
- Blogs
- Juegos
- FAVORITES
- Noticias Feed
Giúp với ạ cảm ơn nhiều
This anwser using AI, please
a) Để xác định cấu hình electron của các nguyên tử fluor (F), nitơ (N) và oxy (O), ta dựa vào số hiệu nguyên tử (Z) của từng nguyên tố.
- Fluor (F, Z=9): Cấu hình electron sẽ là 1s² 2s² 2p⁵.
- Nitơ (N, Z=7): Cấu hình electron là 1s² 2s² 2p³.
- Oxy (O, Z=8): Cấu hình electron là 1s² 2s² 2p⁴.
Dựa vào cấu hình electron, ta có thể dự đoán khả năng liên kết hóa học của các nguyên tố này:
- Fluor có 7 electron trên lớp vỏ ngoài, nên nó rất dễ nhận thêm 1 electron để đạt được cấu hình giống khí hiếm (có cấu hình giống Ne) và thường tham gia phản ứng hóa học dưới dạng ion âm (F⁻).
- Nitơ với 3 electron trên lớp vỏ ngoài thường tham gia liên kết bằng cách chia sẻ electron, có thể tạo ra 3 liên kết với các nguyên tố khác.
- Oxy có 6 electron trên lớp vỏ ngoài, thường nhận 2 electron để đạt cấu hình giống Ne (O²⁻) hoặc cũng có thể chia sẻ electron tạo liên kết đôi.
b) Công thức Lewis là một biểu diễn hóa học thể hiện các electron hóa trị của nguyên tử. Đối với các phân tử F₂, N₂ và O₂:
- F₂: Mỗi nguyên tử fluor có 7 electron hóa trị, và trong phân tử F₂, hai nguyên tử chia sẻ một cặp electron để tạo ra liên kết đơn. Công thức Lewis sẽ là:
F : F
Số electron dùng chung là 2, electron riêng của mỗi fluor là 5.
- N₂: Mỗi nguyên tử nitơ có 5 electron hóa trị. Trong phân tử N₂, hai nguyên tử chia sẻ ba cặp electron tạo ra liên kết ba. Công thức Lewis sẽ là:
N ≡ N
Số electron dùng chung là 6, electron riêng của mỗi nitơ là 2.
- O₂: Mỗi nguyên tử oxy có 6 electron hóa trị. Trong phân tử O₂, hai nguyên tử chia sẻ 2 cặp electron tạo ra liên kết đôi. Công thức Lewis sẽ là:
O = O
Số electron dùng chung là 4, electron riêng của mỗi oxy là 2.
Do đó, ta có thể tổng hợp như sau:
- F₂: F : F (cặp dùng chung)
- N₂: N ≡ N (cặp dùng chung)
- O₂: O = O (cặp dùng chung)
Mỗi cấu trúc này giúp thể hiện cách các nguyên tử tương tác với nhau thông qua liên kết hóa học.
- Fluor (F, Z=9): Cấu hình electron sẽ là 1s² 2s² 2p⁵.
- Nitơ (N, Z=7): Cấu hình electron là 1s² 2s² 2p³.
- Oxy (O, Z=8): Cấu hình electron là 1s² 2s² 2p⁴.
Dựa vào cấu hình electron, ta có thể dự đoán khả năng liên kết hóa học của các nguyên tố này:
- Fluor có 7 electron trên lớp vỏ ngoài, nên nó rất dễ nhận thêm 1 electron để đạt được cấu hình giống khí hiếm (có cấu hình giống Ne) và thường tham gia phản ứng hóa học dưới dạng ion âm (F⁻).
- Nitơ với 3 electron trên lớp vỏ ngoài thường tham gia liên kết bằng cách chia sẻ electron, có thể tạo ra 3 liên kết với các nguyên tố khác.
- Oxy có 6 electron trên lớp vỏ ngoài, thường nhận 2 electron để đạt cấu hình giống Ne (O²⁻) hoặc cũng có thể chia sẻ electron tạo liên kết đôi.
b) Công thức Lewis là một biểu diễn hóa học thể hiện các electron hóa trị của nguyên tử. Đối với các phân tử F₂, N₂ và O₂:
- F₂: Mỗi nguyên tử fluor có 7 electron hóa trị, và trong phân tử F₂, hai nguyên tử chia sẻ một cặp electron để tạo ra liên kết đơn. Công thức Lewis sẽ là:
F : F
Số electron dùng chung là 2, electron riêng của mỗi fluor là 5.
- N₂: Mỗi nguyên tử nitơ có 5 electron hóa trị. Trong phân tử N₂, hai nguyên tử chia sẻ ba cặp electron tạo ra liên kết ba. Công thức Lewis sẽ là:
N ≡ N
Số electron dùng chung là 6, electron riêng của mỗi nitơ là 2.
- O₂: Mỗi nguyên tử oxy có 6 electron hóa trị. Trong phân tử O₂, hai nguyên tử chia sẻ 2 cặp electron tạo ra liên kết đôi. Công thức Lewis sẽ là:
O = O
Số electron dùng chung là 4, electron riêng của mỗi oxy là 2.
Do đó, ta có thể tổng hợp như sau:
- F₂: F : F (cặp dùng chung)
- N₂: N ≡ N (cặp dùng chung)
- O₂: O = O (cặp dùng chung)
Mỗi cấu trúc này giúp thể hiện cách các nguyên tử tương tác với nhau thông qua liên kết hóa học.
Post Reply
© 2025 Học Tốt Online - Chia Sẻ Tài Liệu Học Tập và Giải Bài Tập Miễn Phí  Spanish
Spanish